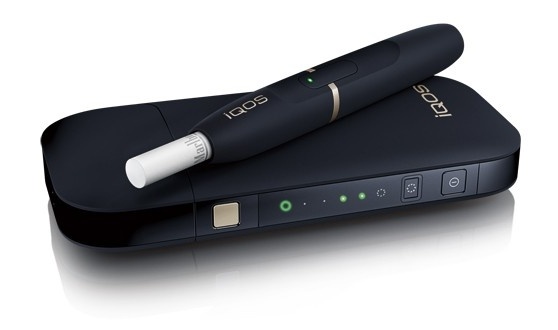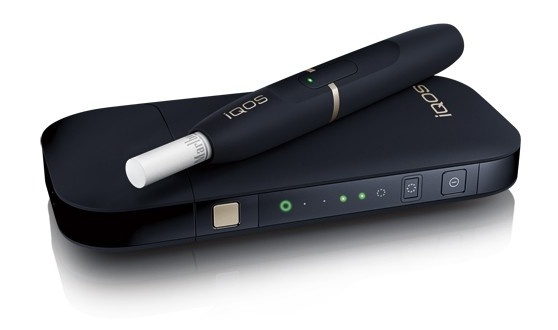
Cette décision démontre qu’IQOS est un produit du tabac fondamentalement différent et un meilleur choix pour les adultes qui, autrement, continueraient à fumer. D’après le texte, IQOS est le premier et le seul produit électronique à base de nicotine à se voir accorder des autorisations de communication par le biais du processus de « Produit du tabac à risque modifié » (Ptrm) de la Fda.
Selon le communiqué la Fda justifie sa décision par le fait que le système IQOS chauffe le tabac mais ne le brûle pas et que ceci permet de réduire considérablement la production de composants chimiques nocifs et potentiellement nocifs. Aussi, argue l’agence américaine, des études scientifiques ont montré que le passage complet des cigarettes conventionnelles au système IQOS réduit l’exposition de votre corps à des composants chimiques nocifs ou potentiellement nocifs.
L’agence a conclu également que les preuves scientifiques disponibles démontrent qu’IQOS est censé être bénéfique pour la santé de la population dans son ensemble, en tenant compte à la fois des consommateurs de produits du tabac et des personnes qui n’en consomment pas actuellement.
Dans le sillage, le document indique que la décision de la Fda s’appuie en outre sur le consensus scientifique international indépendant qui se dessine, selon lequel il est préférable d’opter pour IQOS plutôt que de continuer à fumer, et fait suite à la décision de la Fda d’avril 2019 autorisant la commercialisation d’IQOS aux États-Unis.
Réagissant à l’annonce de la FDA , André Calantzopoulos déclare que "La décision de la FDA est un jalon historique en matière de santé publique. Parmi les dizaines de millions d'hommes et de femmes américains qui fument aujourd'hui, beaucoup arrêteront, mais beaucoup ne le feront pas. Cette décision permet d'informer ces adultes que le passage complet à IQOS est un meilleur choix que de continuer à fumer. La FDA a déterminé que les études scientifiques montrent que le passage complet des cigarettes conventionnelles à IQOS réduit l'exposition à des substances chimiques nocives ou potentiellement nocives.
IQOS est un produit fondamentalement différent des cigarettes combustibles et doit être réglementé différemment, comme l'a reconnu la FDA. Désormais - plus que jamais - il est urgent d'engager une conversation fondamentalement différente sur une approche coopérative pour parvenir à un avenir sans fumée. La décision de la FDA fournit un exemple important de la manière dont les gouvernements et les organisations de santé publique peuvent réglementer les alternatives sans fumée pour les différencier des cigarettes, afin de promouvoir la santé publique.
Nous sommes ravis que cette décision importante contribue à orienter les choix des fumeurs adultes aux États-Unis. Le meilleur choix pour la santé est de ne jamais commencer à fumer ou d'arrêter complètement. Pour ceux qui n'arrêtent pas de fumer, la meilleure chose à faire est de passer à un produit dont l’absence de fumée est scientifiquement fondée. Au 31 mars 2020, PMI estime qu'environ 10,6 millions de fumeurs adultes dans le monde ont déjà arrêté de fumer et sont passés à IQOS. Nous pensons que cette décision peut contribuer à accélérer encore la transition des adultes américains vers un produit sans fumée. Avec notre titulaire de licence Altria, nous nous engageons à prévenir tout usage indésirable et nous soutenons pleinement l'accent mis par la FDA sur la protection de la jeunesse.
Cette décision est le résultat de notre engagement continu à mettre la science au premier plan dans notre quête pour remplacer les cigarettes par des alternatives sans fumée aussi rapidement que possible.
Nous nous réjouissons de travailler avec la FDA pour lui fournir toute information supplémentaire dont elle pourrait avoir besoin, afin de commercialiser IQOS avec des allégations de risque réduit.
L'exploitation d'innovations telles que IQOS pour accélérer de manière spectaculaire le déclin de la consommation de la cigarette est l'opportunité de ce siècle. Une réglementation complète, fondée sur des données scientifiques, peut contribuer à faire passer rapidement les fumeurs adultes qui, autrement continueraient à fumer, vers de meilleures options, tout en se prémunissant contre des conséquences involontaires".
Pour rappel, Philip Morris International (PMI) mène une transformation dans l'industrie du tabac pour créer un avenir sans fumée et, à terme, remplacer les cigarettes par des produits sans fumée, au bénéfice des adultes qui autrement continueraient à fumer, de la société en général, de l'entreprise et de ses actionnaires. PMI est une société internationale de tabac de premier plan qui fabrique et vend des cigarettes, ainsi que des produits sans fumée, des dispositifs et accessoires électroniques associés, ainsi que d'autres produits contenant de la nicotine sur des marchés en dehors des États-Unis.
Bassirou MBAYE
Selon le communiqué la Fda justifie sa décision par le fait que le système IQOS chauffe le tabac mais ne le brûle pas et que ceci permet de réduire considérablement la production de composants chimiques nocifs et potentiellement nocifs. Aussi, argue l’agence américaine, des études scientifiques ont montré que le passage complet des cigarettes conventionnelles au système IQOS réduit l’exposition de votre corps à des composants chimiques nocifs ou potentiellement nocifs.
L’agence a conclu également que les preuves scientifiques disponibles démontrent qu’IQOS est censé être bénéfique pour la santé de la population dans son ensemble, en tenant compte à la fois des consommateurs de produits du tabac et des personnes qui n’en consomment pas actuellement.
Dans le sillage, le document indique que la décision de la Fda s’appuie en outre sur le consensus scientifique international indépendant qui se dessine, selon lequel il est préférable d’opter pour IQOS plutôt que de continuer à fumer, et fait suite à la décision de la Fda d’avril 2019 autorisant la commercialisation d’IQOS aux États-Unis.
Réagissant à l’annonce de la FDA , André Calantzopoulos déclare que "La décision de la FDA est un jalon historique en matière de santé publique. Parmi les dizaines de millions d'hommes et de femmes américains qui fument aujourd'hui, beaucoup arrêteront, mais beaucoup ne le feront pas. Cette décision permet d'informer ces adultes que le passage complet à IQOS est un meilleur choix que de continuer à fumer. La FDA a déterminé que les études scientifiques montrent que le passage complet des cigarettes conventionnelles à IQOS réduit l'exposition à des substances chimiques nocives ou potentiellement nocives.
IQOS est un produit fondamentalement différent des cigarettes combustibles et doit être réglementé différemment, comme l'a reconnu la FDA. Désormais - plus que jamais - il est urgent d'engager une conversation fondamentalement différente sur une approche coopérative pour parvenir à un avenir sans fumée. La décision de la FDA fournit un exemple important de la manière dont les gouvernements et les organisations de santé publique peuvent réglementer les alternatives sans fumée pour les différencier des cigarettes, afin de promouvoir la santé publique.
Nous sommes ravis que cette décision importante contribue à orienter les choix des fumeurs adultes aux États-Unis. Le meilleur choix pour la santé est de ne jamais commencer à fumer ou d'arrêter complètement. Pour ceux qui n'arrêtent pas de fumer, la meilleure chose à faire est de passer à un produit dont l’absence de fumée est scientifiquement fondée. Au 31 mars 2020, PMI estime qu'environ 10,6 millions de fumeurs adultes dans le monde ont déjà arrêté de fumer et sont passés à IQOS. Nous pensons que cette décision peut contribuer à accélérer encore la transition des adultes américains vers un produit sans fumée. Avec notre titulaire de licence Altria, nous nous engageons à prévenir tout usage indésirable et nous soutenons pleinement l'accent mis par la FDA sur la protection de la jeunesse.
Cette décision est le résultat de notre engagement continu à mettre la science au premier plan dans notre quête pour remplacer les cigarettes par des alternatives sans fumée aussi rapidement que possible.
Nous nous réjouissons de travailler avec la FDA pour lui fournir toute information supplémentaire dont elle pourrait avoir besoin, afin de commercialiser IQOS avec des allégations de risque réduit.
L'exploitation d'innovations telles que IQOS pour accélérer de manière spectaculaire le déclin de la consommation de la cigarette est l'opportunité de ce siècle. Une réglementation complète, fondée sur des données scientifiques, peut contribuer à faire passer rapidement les fumeurs adultes qui, autrement continueraient à fumer, vers de meilleures options, tout en se prémunissant contre des conséquences involontaires".
Pour rappel, Philip Morris International (PMI) mène une transformation dans l'industrie du tabac pour créer un avenir sans fumée et, à terme, remplacer les cigarettes par des produits sans fumée, au bénéfice des adultes qui autrement continueraient à fumer, de la société en général, de l'entreprise et de ses actionnaires. PMI est une société internationale de tabac de premier plan qui fabrique et vend des cigarettes, ainsi que des produits sans fumée, des dispositifs et accessoires électroniques associés, ainsi que d'autres produits contenant de la nicotine sur des marchés en dehors des États-Unis.
Bassirou MBAYE



 chroniques
chroniques